Réactions acido-basiques
Acides et bases selon Bronsted
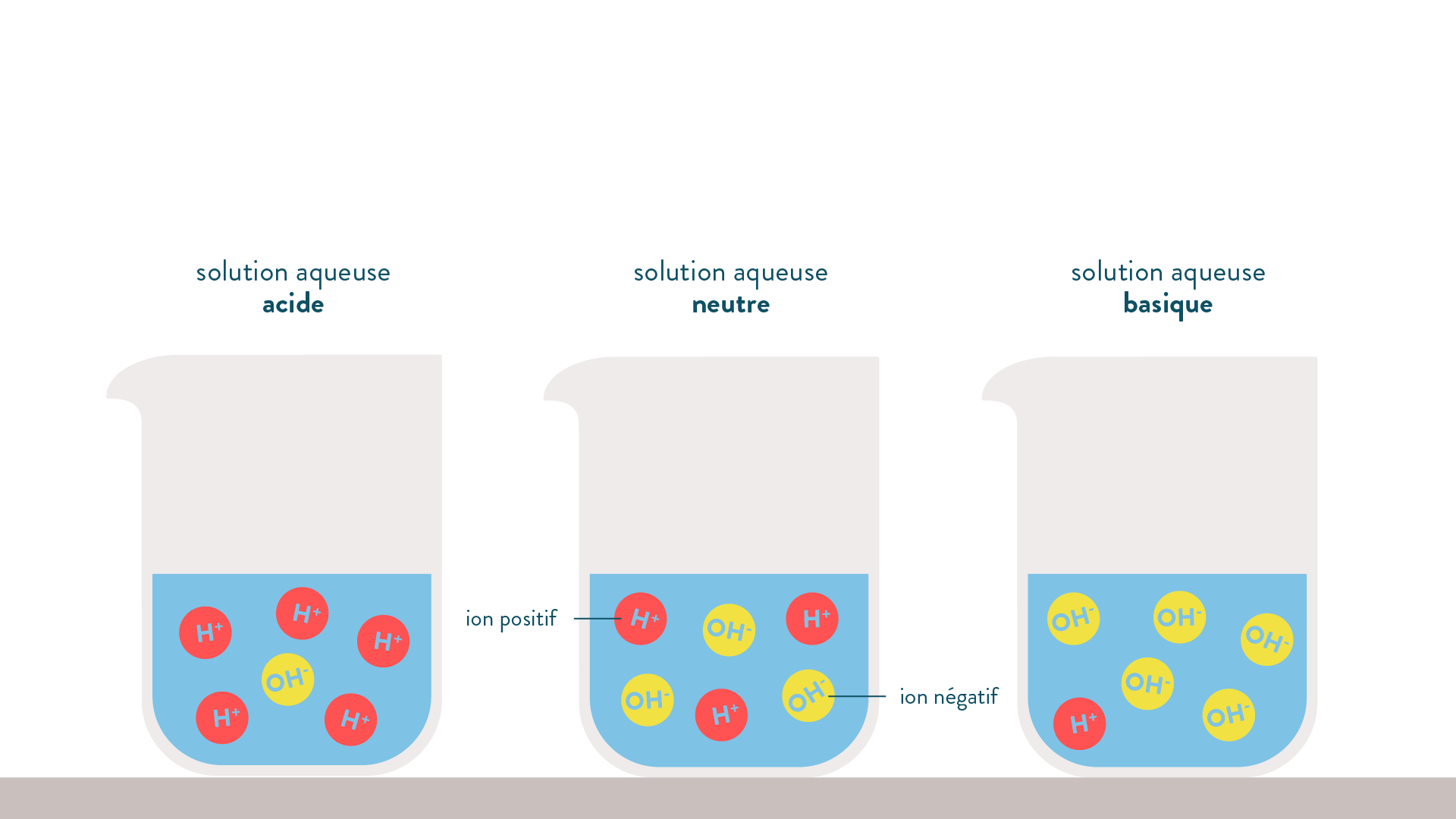
Un acide
تعريف
Un acide AH est toute espèce chimique capable de céder un proton H+ au cours d’une transformation chimique $$A H \rightleftharpoons A^{-}+H^{+}$$
مثال
L’acide nitrique $$\mathrm{HNO}_{3}$$
L’acide sulfurique $$\mathrm{H}_{2} \mathrm{SO}_{4}$$
Une base
تعريف
Une base B est toute espèce chimique capable de capter un proton H+ au cours d’une transformation chimique $$B+H^{+} \rightleftharpoons B H^{+}$$
مثال
L’oxyde de sodium $$\mathrm{Na}_{2} \mathrm{O}$$
L’oxyde de potassium $$\mathrm{K}_{2} \mathrm{O}$$
Couple acide / base
تعريف
Quand un acide cède un proton, il se transforme en sa base conjuguée, quand une base capte un proton, elle se transforme en son acide conjugué, les deux forment un couple acide-base.
مثال
$$A H /_{A^{-}} \Rightarrow A H \rightleftharpoons A^{-}+H^{+}$$
$$N H_{4}^{+} /_{N H_{3}} \Rightarrow N H_{4}^{+} \rightleftharpoons N H_{3}+H^{+}$$
Réactions acido-basiques
Une réaction acido-basique est une réaction au cours de laquelle il y a un transfert d’u proton $$H^{+}$$ entre l’acide d’un couple et la base d’un autre couple
$$H C l /_{C l^{-}} \Rightarrow \mathrm{HCl} \rightleftarrows \mathrm{Cl}^{-}+\mathrm{H}^{+}$$
$$\mathrm{H}_{3} \mathrm{O}^{+} / \mathrm{H}_{2} \mathrm{O} \Rightarrow \mathrm{H}_{2} \mathrm{O}+\mathrm{H}^{+} \rightleftarrows \mathrm{H}_{3} \mathrm{O}^{+}$$
$$\mathrm{HCl}+\mathrm{H}_{2} \mathrm{O} \rightleftharpoons \mathrm{Cl}^{-}+\mathrm{H}_{3} \mathrm{O}^{+}$$
Transformations totales et non totales
لمواصلة هذا الملخص، قم بالتسجيل بالمجان في كيزاكو

- ملخصات الدروس غير محدودة
- فيديو مجاني في كل درس
- تمرين مصحح مجاني
- اختبار تفاعلي