Introduction:
Une solution électrolytique est obtenue par dissolution d'un soluté (solide ionique, liquide, ou gaz) dans un solvant (l'eau en général). La dissolution d'un soluté est une transformation chimique décrite par trois étapes : dissociation, solvatation et dispersion.
On distingue ainsi la concentration du soluté apporté et celle des espèces chimiques (les ions) présentes en solution.
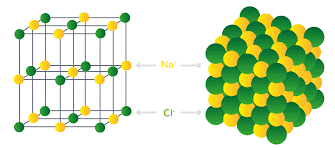
Le corps solide ionique :
- Un solide ionique est un assemblage régulier d’anions (ions -) et de cations (ions +)
- C’est l’ensemble des interactions électriques qui permettent de maintenir la forme du cristal et qui assure sa cohésion.
- Le corps solide ionique est électriquement neutre : les charges positives des cations et les charges négatives des anions se compensent, il donne un isolent électrique.
مثال
√ Le chlorure de sodium est constitué d’un assemblage compact et ordonné d’ions sodium et d’ions chlorure. La formule statistique du cristal est NaCl. Le cristal est électriquement neutre. Il contient autant d’ions sodium que d’ions chlorure.
√ Chaque ion se trouve en contact avec des ions de signes contraires. Il en résulte une structure régulière dans laquelle un motif se répète à des millions d’exemplaires, le motif est appelé maille élémentaire, on obtient un cristal à l’échelle macroscopique
Caractère dipolaire d’une molécule:
La liaison covalente et l’électronégativité :
L’électronégativité d’un élément est la tendance d’un atome de cet élément à attirer le doublé d’une liaison de covalence qu’il forme avec un autre atome.
Remarque
Dans le tableau périodique des éléments chimiques, L’électronégativité augmente de gauche à droite d’une ligne(période) et de bas vers le haut d’une colonne.
L’élément le plus électronégatif est donc le fluor.
La liaison covalente est produite entre deux atomes dans laquelle chaque atome participe avec un ou plusieurs électrons de sa couche externe afin de former un doublet d’électrons liant les deux atomes.
La molécule est polaire si le barycentre des charges positives ne coïncide pas avec celui des charges négatives.
Dans le cas d’une molécule composée de deux atomes identiques, le doublet d’électrons liant n’est pas attiré vers aucun des deux atomes. Alors on dit que la liaison covalente n’est pas polarisée et la molécule est non polaire.
Dans le cas d’une molécule composée de deux atomes différents, l’atome le plus électronégatif attire le doublet d’électrons liant vers lui, alors on dit que la liaison covalente est polarisée.
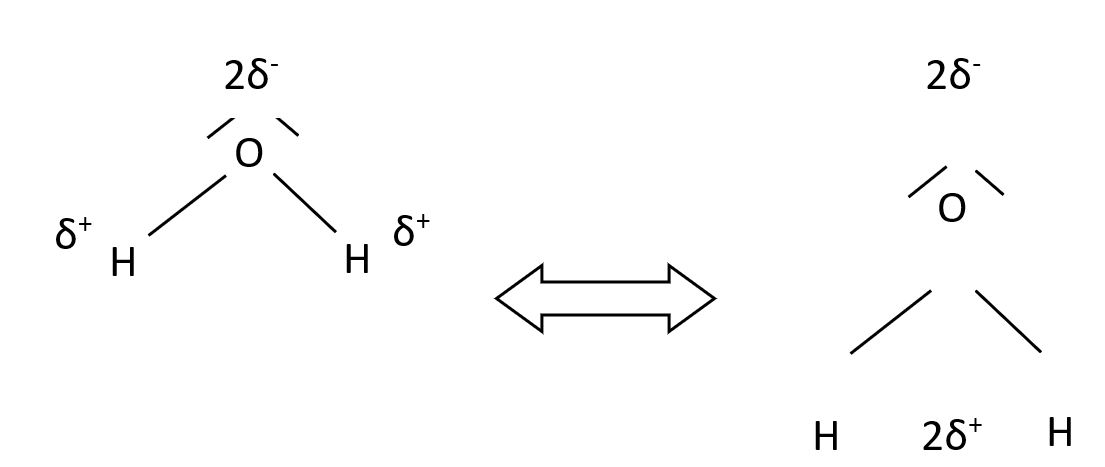
Ainsi, il en résulte l’apparition d’une petite fraction de la charge négative (δ-)sur l’atome le plus électronégatif alors qu’une petite fraction de la charge positive (δ+) apparaît sur l’autre atome.
مثال
1) Considérons une molécule composée de deux atomes identiques : $H_2$
Le doublet liant (constitué de deux électrons) se situe en moyenne à égale distance des deux noyaux des atomes puisque les deux atomes ont la même électronégativité.
Donc on dit que la molécule est polaire.
Les molécules ayant le caractère dipolaire ont une solubilité dans l’eau et agissent comme un dipôle électrostatique.
2) La polarité d’une molécule de chlorure d’hydrogène:
Vu que le chlore est beaucoup plus électronégatif que l’hydrogène, dans cette molécule, le doublet liant est beaucoup plus proche de l’atome de chlore que de celui d’hydrogène.
On modélise cela en disant que l’atome de chlore possède un excédent de charges négatives (noté δ-) alors que l’atome d’hydrogène possède un défaut de charges négatives (noté δ+).
La liaison H-Cl est dite polarisée.
La molécule HCl a un caractère dipolaire.
3) la polarité d’une molécule d’eau:
Le barycentre des charges négatives est différent du barycentre des charges positives : La molécule d’eau a un caractère dipolaire.
Remarque
Le caractère dipolaire d’une molécule n’est pas seulement lié à l’existence des liaisons covalentes polarisées, mais aussi à sa forme géométrique.
ما يجب معرفته
- L'électronégativité est la capacité d'un atome à attirer vers lui le ou les électrons d'un autre atome, électrons mis en commun dans une liaison covalente.
- Dans la classification périodique des éléments, l'électronégativité augmente de bas en haut (dans une colonne) et de gauche à droite (dans une ligne).
- L'élément le moins électronégatif est le césium(Cs) et le plus électronégatif le fluor(F).
Les solutions électrolytiques :
لمواصلة هذا الملخص، قم بالتسجيل بالمجان في كيزاكو

- ملخصات الدروس غير محدودة
- فيديو مجاني في كل درس
- تمرين مصحح مجاني
- اختبار تفاعلي