L’oxydo-réduction a une importance considérable dans tous les processus physico-chimiques qui nous entourent. Certains phénomènes peuvent être aisément rationalisés en tenant compte du caractère oxydant ou réducteur des substances en présence, ce genre de réaction est a l’origine des dommages provoqués par la corrosion, l’incendie ou l’explosion.
⇒ Alors, comment on peut définir les réactions d’oxydo-réduction ?
Réaction d'oxydo-réduction, oxydant, réducteur
تعريف
On a vu dans le cour des réaction acido-basiques que une réaction acido-basique est une transfert, ou bien un échange de proton H+ entre deux espèces chimiques (acide et base ), par contre , une réaction d’oxydo-réduction représente un transfert des électrons (e-) entre un oxydant et un réducteur .
مثال
La formation de la rouille : est un exemple très connu et très célèbre de la réaction d’oxydo-réduction, C'est une réaction d'oxydation lente qui aboutit à la formation d'oxydes ou d'hydroxydes. Elle est de couleur brun-rouge, elle est le résultat d’une réaction entre le fer et le dioxygène
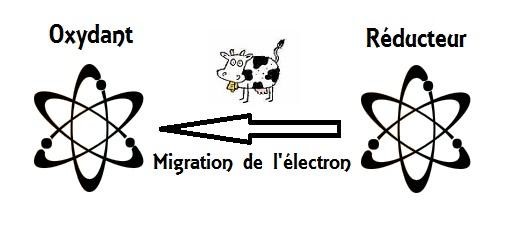
- La réaction d’oxydo-réduction est donc un échange d’électrons entre des espèces chimiques l’un s’appelle oxydant et l’autre s’appelle réducteur :
On peut faire une définition similaire à celle de l’acide et de base.
- L’oxydant : est un espèce chimique capable de capter un ou plusieurs électrons e- lors d’une réaction chimique .
- Le réducteur : est un espèce chimique capable de perdre un ou plusieurs électrons e- lors d'un’ transformation chimique.
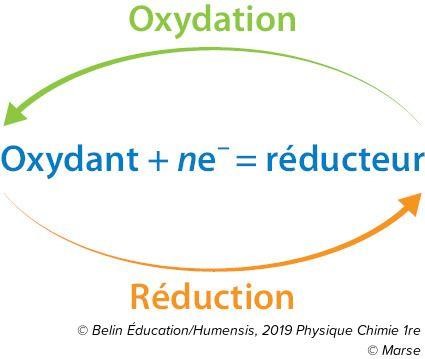
- On appelle l’oxydation tout perte d’électrons e- par un espèce chimique ( c’est le réducteur qui subit l’oxydation )
- Et on appelle la réduction tout gain d’électrons e- par un élement chimique ( c’est l’oxydant qui subit la réduction ).
Couple oxydant / réducteur
لمواصلة هذا الملخص، قم بالتسجيل بالمجان في كيزاكو

- ملخصات الدروس غير محدودة
- فيديو مجاني في كل درس
- تمرين مصحح مجاني
- اختبار تفاعلي