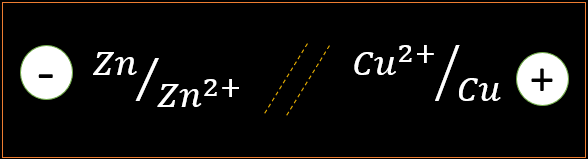Les piles
تعريف
Une pile électrochimique est un générateur qui transforme de l’énergie chimique fournie par une réaction d’oxydoréduction spontanée en énergie électrique.
Transferts spontanés directs
Lorsque les espèces chimiques de deux couples oxydant / réducteur réagissent dans un mélange, il y a transfert spontanée direct d’électrons par contact entre l’oxydant d’un couple et le réducteur d’un autre couple
Transferts spontanés indirect d’électrons
Une pile électrochimique est un générateur qui transforme de l’énergie chimique fournie par une réaction d’oxydoréduction spontanée en énergie électrique.
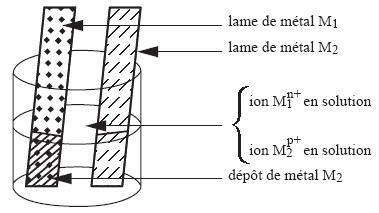
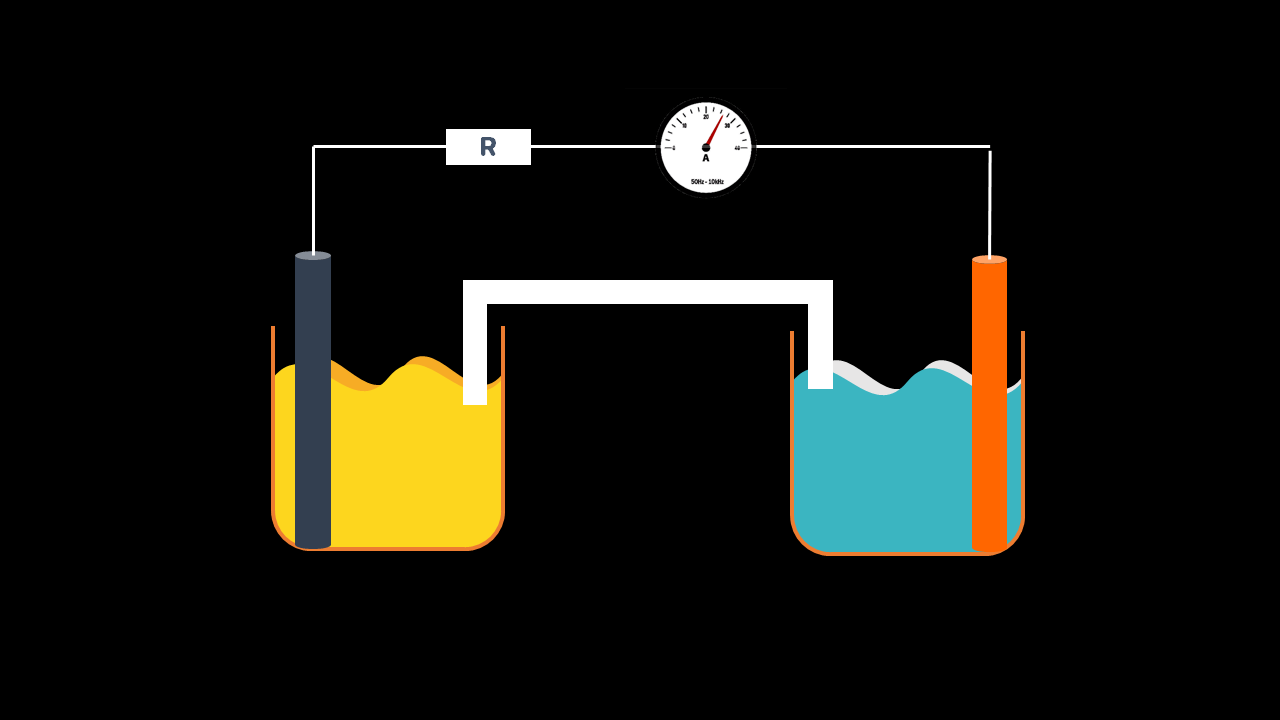
Constitution d’une pile
Une pile est constituée de :
Deux demi-piles formées par deux couples oxydant/réducteur : $$\mathrm{Cu}^{2+} / \mathrm{Cu}$$ et $$\mathrm{Zn}^{2+} / \mathrm{Zn}$$ : la première demi-pile est formé par un métal $$\mathrm{Cu}_{(\mathrm{s})}$$ qui plonge dans une solution contenant les cations métalliques $$\mathrm{Cu}^{2+}$$ et la seconde par un métal $$\mathrm{Zn}_{(s)}$$ plongeant dans une solution contenant les cations métalliques $$\mathrm{Zn}^{2+}$$
D’un pont électrolytique, appelé aussi pont salin, qui relie les deux solutions :
- Ces solutions sont appelés électrolytes ou solutions électrolytiques ou ioniques.
- Les deux métaux $$\mathrm{Cu}_{(s)}$$ et $$\mathrm{Zn}_{(s)}$$, appelés électrodes, constituent les pôles ou les bornes de la pile.
Anode
تعريف
L’anode est l’électrode qui est le siège d’une réaction d’oxydation : Production d’électrons, c’est la borne négative de la pile.
مثال
$$Z n \rightleftharpoons Z n^{2+}+2 e^{-}$$
Cathode
تعريف
La cathode est le siège d’une réaction de réduction : Consommation d’électrons, c’est la borne positive de la pile.
مثال
$$\mathrm{Cu}^{2+}+2 e^{-} \rightleftharpoons \mathrm{Cu}$$
Méthodes de détermination (anode/cathode)
Méthode 1 : observation
L’électrode où se produit l’oxydation représente l’anode, la borne négative de la pile.
L’électrode où se déroule la réduction constitue la cathode, la borne positive de la pile.
Méthode 2 : Schéma conventionnel
La borne positive est toujours placée à droite et le pont électrolytique est représenté par double trait (//)
Méthode 3 : Le quotient de réaction
Le critère d’évolution spontanée permet de connaitre le sens de la réaction qui se déroule pour atteindre l’équilibre et on en déduit les réactions qui se produisent aux électrodes (anode et cathode) et qui donnent ensuite le déplacement des porteurs de charge.
Méthode 4 : Pôle (com,A)
On branche un ampèremètre entre les bornes de la pile.
Si l’ampèremètre indique une intensité du courant électrique positive, alors sa borne COM est donc liée au pôle négatif de la pile, et s’il indique une intensité du courant électrique négative, sa borne COM est liée au pôle positif de la pile.
L’étude Chimique d’une pile
لمواصلة هذا الملخص، قم بالتسجيل بالمجان في كيزاكو

- ملخصات الدروس غير محدودة
- فيديو مجاني في كل درس
- تمرين مصحح مجاني
- اختبار تفاعلي